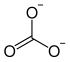
Das Salz bildet ein farbloses, schwach nach Ammoniak riechendes Pulver. Es hat eine Dichte um 1,6 g·cm−3 (bei 20 °C). In wässriger Lösung reagiert dieses Salz, das als Kation eine schwache Säure, und als Anion eine schwache Base hat, leicht basisch. Der pH-Wert ist die Folge eines komplizierten Gleichgewichts, das sich gemäß der Salzhydrolyse einstellt zwischen gelöstem Ammoniak NH3, Ammoniumionen NH4+, Carbonationen CO32−, Hydrogencarbonationen HCO3− und Kohlenstoffdioxid CO2. Der pH-Wert einer 10%igen wässrigen Lösung von Ammoniumcarbonat liegt bei 9,4.
Das Salz Ammoniumcarbonat reagiert also im Zuge der Auflösung in Wasser zu Hydrogencarbonat- und Hydroxidionen. Eine wässrige Lösung von Ammoniumcarbonat ist daher nur im neutralen und schwach basischen Milieu beständig – bei Zugabe starker Säuren entweicht gasförmiges Kohlenstoffdioxid, bei Zugabe konzentrierter Laugen entweicht Ammoniakgas.
Als Trockensubstanz zersetzt sich Ammoniumcarbonat an der Luft langsam, beim Erhitzen erfolgt die Zersetzung heftig.


















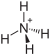
![{mathrm { ! {Biggr ]}_{2}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/574adab1409cb81da6c38bb738ad111e61bbb2d9)
![{mathrm { ! {Biggr ]}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/c9fd9553a0b623f5f669641be907d9186e35b739)


