In den Proteinen kommt, neben anderen Aminosäuren, ausschließlich L-Prolin [Synonym: (S)-Prolin] peptidisch gebunden vor. Enantiomer dazu ist das spiegelbildliche D-Prolin [Synonym: (R)-Prolin]. Racemisches DL-Prolin [Synonyme: (RS)-Prolin bzw. (±)-Prolin] hat nur geringe Bedeutung.
Wenn in diesem Text oder in der wissenschaftlichen Literatur „Prolin“ ohne weiteren Namenszusatz (Präfix) erwähnt wird, ist L-Prolin gemeint.
| Name | L-Prolin | D-Prolin |
| Andere Namen | (S)-Prolin | (R)-Prolin |
| Strukturformel |  | 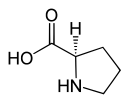 |
| CAS-Nummer | 147-85-3 | 344-25-2 |
| 609-36-9 (DL) | ||
| EG-Nummer | 205-702-2 | 206-452-7 |
| 210-189-3 (DL) | ||
| ECHA-Infocard | 100.005.185 | 100.005.866 |
| 100.009.264 (DL) | ||
| PubChem | 145742 | 8988 |
| 614 (DL) | ||
| DrugBank | DB00172 | – |
| – (DL) | ||
| Wikidata | Q20035886 | Q20035962 |
| Q484583 (DL) | ||










