Die weltweit größten Kalisalzvorkommen (Tabelle der Länder nach Abbau siehe dort) liegen in Kanada, Russland, Belarus, Vereinigte Staaten, China und Deutschland, auch in einigen Binnengewässern wie dem Toten Meer oder der Wüste Lop Nor findet sich Kaliumcarbonat. Früher wurde Pottasche vorwiegend aus Holzasche durch Auslaugen gewonnen. Der Gehalt mineralischer Bestandteile an Holzasche liegt bei etwa 85 %; etwa 14–19 % davon sind Kaliumcarbonat und Natriumcarbonat. Weltweit wurden 2020 ca. 44 Millionen Tonnen Kaliumsalze (als K2O-Gehalt) abgebaut. Größte Produzenten waren Kanada, Russland, Belarus und China, die zusammen ca. 80 % Marktanteil hatten. Es wird erwartet, dass sowohl Nachfrage, als auch Produktionskapazitäten in den nächsten Jahren weiter ansteigen werden. Neue Minen oder Erweiterungen von bestehenden Minen werden gerade in Kanada, Russland, Belarus, Eritrea, Australien und Großbritannien umgesetzt. Auch in den USA befand sich 2021 eine neue Kalisalz-Mine im Osceola County (Michigan) in der Entwicklung. Die Mine soll anfangs jährlich 650.000 Tonnen MOP-Qualität (Muriate of potash eine Mischung aus >95 % KCl und NaCl zur Düngemittelherstellung) erzeugen und im Endausbau 1 Million Tonnen pro Jahr. Die weltweiten Ressourcen werden auf 250 Milliarden Tonnen geschätzt.
Kaliumcarbonat
Kaliumcarbonat (fachsprachlich) oder Kaliumkarbonat (Trivialname: Pottasche), K2CO3, ist ein Alkali und das Kaliumsalz der Kohlensäure. Es bildet ein weißes, hygroskopisches Pulver mit einem Schmelzpunkt von 891 °C und einer Dichte von 2,428 g·cm−3. Kaliumcarbonat wird häufig als Rohstoff für die Herstellung von Glas, Seife, Lebensmitteln, Düngemitteln und anderen chemischen Produkten verwendet.
Der Name Pottasche stammt von der alten Methode zur Anreicherung von Kaliumcarbonat aus Pflanzenasche (vor allem Holz-, aber auch Seetangasche) durch Auswaschen mit Wasser (daher auch die Bezeichnung als ein „Laugensalz“) und anschließendes Eindampfen in Pötten (Töpfen). Der traditionelle Name stand auch Pate für die englischen Namen potash und potassium, wobei potash viele mineralische Kaliumsalze einschließt (z. B. Kaliumchlorid) und besser mit Kalisalz übersetzt werden sollte.
- Carbonisierung von Kalilauge:
- Als CO2-Quelle nutzt man überwiegend Verbrennungsgase.
- Reaktion von Kalkmilch (Calciumhydroxid-Lösung) mit Kaliumsulfat und Kohlenstoffmonoxid bei 30 bar (Formiatverfahren). Das abgetrennte Kaliumformiat wird anschließend oxidativ calciniert:
- Auslaugen von Pflanzenasche und anschließendes Eindampfen in Aschenhäusern (historisch, technisch keine Bedeutung mehr)
- historisch: Brennen von Weinstein (Tartarus calcinatus ist gebrannter Weinstein), etwa bei Paracelsus
Kaliumcarbonat lässt sich nicht wie Natriumcarbonat nach dem Solvay-Verfahren gewinnen, da das Zwischenprodukt Kaliumhydrogencarbonat (KHCO3) zu gut löslich ist.
Im Bereich von Lebensmittelzusatzstoffe agieren zahlreiche Unternehmen, die mit ihren Produkten und Dienstleistungen Lösungen für dieses Thema anbieten. Die Firmenliste bietet einen umfassenden Überblick über die Akteure, die im Bereich Lebensmittelzusatzstoffe eine Schlüsselrolle spielen. Von etablierten Branchenführern bis hin zu aufstrebenden Start-ups, jedes Unternehmen trägt auf seine Weise zur Dynamik und Entwicklung von Lebensmittelzusatzstoffe bei.
| Unternehmen | Herkunft | Typ |
|---|---|---|

|
Marly, Schweiz | Hersteller |

|
Hamburg, Deutschland | Hersteller |

|
Laudenbach, Deutschland | Hersteller |

|
Lausanne, Schweiz | Dienstleister |

|
Emmerthal, Deutschland | Hersteller |

|
Epalinges, Schweiz | Hersteller |

|
Zürich, Schweiz | Dienstleister |

|
Burnaby, Kanada | Hersteller |

|
München, Deutschland | Hersteller |
In Wasser ist es sehr leicht und gut löslich (1120 g/l), wobei Wärme frei wird. Die Lösung reagiert durch Bildung von Hydroxidionen alkalisch:
- Ein Carbonation reagiert mit Wasser zu einem Hydrogencarbonation und einem Hydroxidion.
Mit Säuren entstehen unter Kohlenstoffdioxidentwicklung die entsprechenden Kaliumsalze. Bei Raumtemperatur kristallisiert es als Dihydrat aus der wässrigen Lösung.
Wasserfreies Kaliumcarbonat kristallisiert monoklin, Raumgruppe P21/c (Raumgruppen-Nr. 14)Vorlage:Raumgruppe/14 mit den Gitterparametern a = 5,640 Å, b = 9,839 Å, c = 6,874 Å und β = 98,70°. Bei 250 °C geht diese in die monokline β-Form über (Raumgruppe C2/c (Nr. 15)Vorlage:Raumgruppe/15, a = 5,675 Å, b = 9,920 Å, c = 7,018 Å und β = 96,8°). Bei 450 °C geht diese in eine hexagonale Form über.
- Zusatz bei der Herstellung von Glas
- Herstellung von Schmierseifen
- Herstellung von Kaligläsern
- Herstellung von Farben
- Herstellung von fotografischen Entwicklern
- Herstellung von Düngemitteln (kaliumliefernde Komponente)
- wasserfreies Kaliumcarbonat wird im Laborbereich gelegentlich als Trocknungsmittel eingesetzt.
- Triebmittel für Flachgebäck (Plätzchen und Lebkuchen, besonders Weihnachtsbäckerei) und Teige mit hohem Zuckergehalt
- Zusatz zu Kakao als Säureregulator
- Zusatzstoff zur Bohrspülung bei Tiefbohrungen für die Toninhibitierung
- Neutralisationsmittel bei der Verwendung von Salzsäure (E 507) als Aromaverstärker
- Schnelltrocknung von Rosinen: Durch Entfernen der natürlichen Wachsschicht der Trauben verdunstet die Feuchtigkeit leichter.
- Ausgangsprodukt für andere Kaliumverbindungen
- Trennmittel für Gipsabdrücke (Bildhauerei)
- Elektrolytbestandteil in Schmelzkarbonatbrennstoffzellen
- Tabakzusatzstoff für Schnupftabak (in Deutschland laut Tabakverordnung)
- Zusatzstoff für die Einnahme von bestimmten Suchtmitteln
- Zusatzstoff in manchen Handwasch-Flüssigseifen
- umweltfreundliches Auftaumittel (anstelle von Auftausalz) bei Glatteis auf Straßen und Gehwegen
- aufgrund des stets enthaltenen radioaktiven Kalium-40 kann Pottasche für Schülerversuche zur Radioaktivität verwendet werden
- Reinigung (Beuchen) von Leinen und Baumwolle mittels Buchenasche
- Bestandteil von Feuerlöschmitteln
In der Welt des Themas Lebensmittelzusatzstoffe gibt es ständig Neues zu entdecken. Aktuelle Entwicklungen und spannende Meldungen bieten tiefe Einblicke und erweitern das Verständnis für dieses dynamische Feld. Von bahnbrechenden Entdeckungen bis hin zu wichtigen Ereignissen – die Entwicklungen für das Thema Lebensmittelzusatzstoffe sind ein Spiegelbild des stetigen Wandels und der Innovation in diesem Bereich.
Der Soda-Pottasche-Aufschluss wird für schwerlösliche (Erdalkali-)Sulfate, hochgeglühte (saure oder amphotere) Oxide, Silicate und Silberhalogenide verwendet; der Aufschluss findet in einer Na2CO3/K2CO3-Schmelze statt. ZrO2, Zr3(PO4)4, Al2O3, Cr2O3 und Fe2O3 werden nur teilweise gelöst. Für diesen Schmelzeaufschluss verwendet man Soda und Pottasche im Gemisch, weil damit eine Schmelzpunkterniedrigung gegenüber reinen Salzen zu erhalten ist (Eutektisches Gemisch). Zudem drängt der enorme Carbonatüberschuss das Reaktionsgleichgewicht auf die Produktseite.
Ein Beispiel für Sulfate:
Im Bereich von Lebensmittelzusatzstoffe bieten White Papers und Fachartikel weitergehende Einblicke und fundiertes Wissen. Diese Sammlung von Fachwissen bietet Ressourcen für alle, die sich eingehend mit den Facetten und Nuancen des Themas Lebensmittelzusatzstoffe beschäftigen möchten. Diese Auswahl an Veröffentlichungen deckt ein breites Spektrum ab – von theoretischen Überlegungen bis hin zu praktischen Anwendungen und Fallstudien - und umfasst Arbeiten von Experten, die Licht auf die komplexen Aspekte von Lebensmittelzusatzstoffe werfen.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
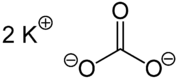 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Kaliumcarbonat | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | K2CO3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer, hygroskopischer Feststoff | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 138,20 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
2,428 g·cm−3 | |||||||||||||||||||||
| Schmelzpunkt |
891 °C | |||||||||||||||||||||
| Siedepunkt |
Zersetzung | |||||||||||||||||||||
| Löslichkeit |
sehr leicht in Wasser (1120 g·l−1 bei 20 °C) | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten |
1870 mg·kg−1 (LD50, Ratte, oral) | |||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−1151,0 kJ/mol | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||

Holen Sie sich die Lebensmittel- und Getränke-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für die Lebensmittel- und Getränkeindustrie bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.











