Eine neue Methode zum Schutz vor Pflanzenkrankheitserregern könnte zur globalen Ernährungssicherheit beitragen
Durch die Veränderung eines pflanzlichen intrazellulären Immunrezeptors (NLR) haben Forscher eine potenzielle neue Strategie zur Resistenz gegen die Reisbräune entwickelt, eine der wichtigsten Krankheiten, die die weltweite Ernährungssicherheit bedroht. Das Team aus dem Vereinigten Königreich und Japan hat seine Forschungsergebnisse kürzlich in PNAS veröffentlicht. Dies könnte sich auf künftige Konzepte für den Pflanzenschutz und letztlich auf die Stabilität der weltweiten Nahrungsmittelversorgung auswirken.
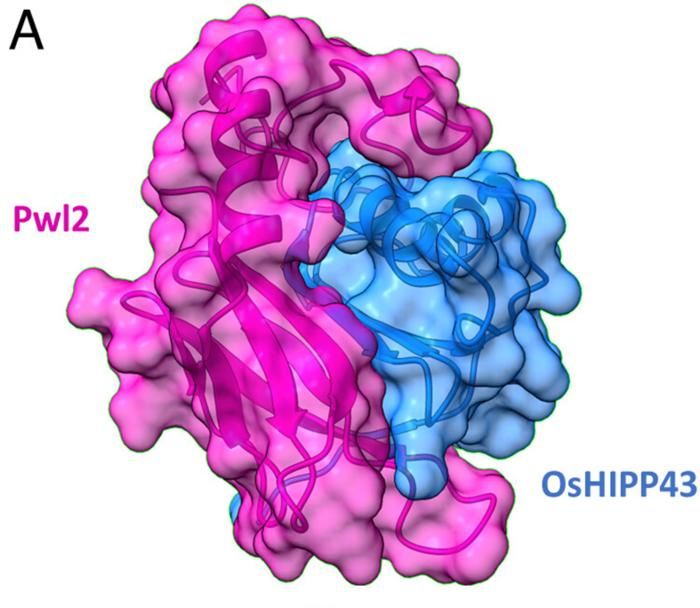
Die Kristallstruktur des Komplexes zeigt eine ausgedehnte Schnittstelle zwischen Pwl2 und OsHIPP43.
PNAS
Die Forschung wurde von der Abteilung für Biochemie und Stoffwechsel am John Innes Centre geleitet, mit Partnern am Sainsbury Laboratory, University of East Anglia, und der Division of Genomics and Breeding, Iwate Biotechnology Research Center, Japan. Für einen wichtigen Teil der Studie arbeiteten die Forscher mit dem nationalen Synchrotron des Vereinigten Königreichs, der Diamond Light Source, zusammen.
Die Reissprengkrankheit ist nach wie vor eine der hartnäckigsten Krankheiten, die die weltweite Ernährungssicherheit bedrohen. Diese Krankheit wird durch den FadenpilzMagnaporthe oryzae verursacht und ist direkt für den Verlust von mehr als 30 % der jährlichen Reisernte verantwortlich. Dieser Erreger kann auch bei anderen Getreidearten wie Weizen und Gerste die Blastenkrankheit verursachen.
Die derzeitigen Ansätze zur Entwicklung dauerhafter Krankheitsresistenzen auf dem Feld sind durch die Geschwindigkeit, mit der sie in der Natur identifiziert werden können, und die Entwicklung von Pflanzenpathogenen wie dem Blastenpilz, die diese neuen Resistenzen umgehen können, begrenzt. Das Bioengineering von pflanzlichen Immunrezeptoren wie NLRs hat sich als neuer Weg zur Erzeugung neuartiger Krankheitsresistenzeigenschaften erwiesen, um der wachsenden Bedrohung der globalen Lebensmittelsicherheit durch Pflanzenpathogene entgegenzuwirken, die potenziell auf Abruf entwickelt werden können.
Rafał Zdrzałek, der Hauptautor , erklärt: "Krankheitserreger schütten Proteine, sogenannte "Effektoren", in die Wirtszellen aus, um den Pflanzenstoffwechsel zu manipulieren und die Infektion zu fördern. Pflanzen können diese Effektoren mit Hilfe von Immunrezeptoren, den sogenannten NLRs, erkennen. Es ist jedoch nicht immer einfach, einen Rezeptor zu definieren, der einen bestimmten Effektor auf natürliche Weise erkennt, und selbst wenn ein solcher Rezeptor existiert, können die Effektoren des Pathogens mutieren und sich so entwickeln, dass sie dieser Erkennung entgehen. Die Wechselwirkungen zwischen den Effektoren der Krankheitserreger und den pflanzlichen Rezeptoren werden untersucht, um den Modus Operandi der einzelnen Krankheitserreger zu verstehen, aber auch, um die natürlichen pflanzlichen Rezeptoren zu manipulieren und ihre Erkennungsspezifität zu verändern.
In ihrer Veröffentlichung konzentrierten sich die Forscher darauf, einen NLR-Immunrezeptor aus Reis so zu verändern, dass er eine breitere, konservierte Effektor-Familie des Blast-Pilzerregers robust bindet. Mark Banfield, der korrespondierende Autor, fügt hinzu: "Durch die Erkennung einer konservierten Effektor-Familie stellt dieser gentechnisch veränderte Immunrezeptor ein Proof-of-Principle für die künftige Bereitstellung einer robusten, länger anhaltenden Resistenz gegen die Blastenkrankheit in der Landwirtschaft dar. Es könnte für den Erreger schwieriger sein, sich zu entwickeln, um der Erkennung zu entgehen. Das Konzept des Host-Target-Immunrezeptor-Engineerings könnte auch auf andere Pflanzenkrankheiten anwendbar sein, die für ihre krankheitsverursachenden Eigenschaften auf die Einschleusung von Effektoren in die Wirtszellen angewiesen sind."
Durch den Austausch der Schwermetall-assoziierten Domäne (HMA) des Reis-NLR Pikm-1 mit der Domäne des Reisproteins OsHIPP43 (dem natürlichen Ziel des Pwl2-Effektors) gelang es den Forschern, das Reaktionsprofil des Rezeptors so zu verändern, dass er Pwl2 und die breitere Pwl-Effektor-Familie erkennt und auf sie reagiert.
Die Forscher sammelten Röntgenbeugungsdaten an der I04-Beamline des nationalen Synchrotrons des Vereinigten Königreichs, der Diamond Light Source, um die Details der Interaktion zwischen diesen beiden Proteinen zu untersuchen. Die Kristallstruktur des Komplexes zeigt eine ausgedehnte Schnittstelle zwischen Pwl2 und OsHIPP43.
Die Ergebnisse der Studie zeigen das Potenzial des auf Wirtszielen basierenden NLR-Engineerings für die Entwicklung neuer Resistenzeigenschaften, die weniger anfällig für eine Überwindung durch die Pathogenevolution sein könnten. Diese Forschung könnte weitreichende Auswirkungen auf die Zukunft des Pflanzenschutzes und die Stabilität der weltweiten Lebensmittelversorgung haben.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.
Originalveröffentlichung
Rafał Zdrzałek, Yuxuan Xi, Thorsten Langner, Adam R. Bentham, Yohann Petit-Houdenot, Juan Carlos De la Concepcion, Adeline Harant, Motoki Shimizu, Vincent Were, Nicholas J. Talbot, Ryohei Terauchi, Sophien Kamoun, Mark J. Banfield; "Bioengineering a plant NLR immune receptor with a robust binding interface toward a conserved fungal pathogen effector"; Proceedings of the National Academy of Sciences, Volume 121, 2024-7-5