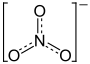
Im Jahr 1736 stellte Duhamel Natriumnitrat erstmals synthetisch dar. Die ersten Ladungen von Chilesalpeter erreichten England in den 1820er Jahren. Im Laufe der Zeit stieg der Verbrauch und 1859 importierte England bereits 47.000 Tonnen. Schon 1870 wurden von Iquique – heute eine Hafenstadt im Norden Chiles, damals zu Peru gehörend – bereits 147.000 Tonnen Chilesalpeter nach Liverpool und Hamburg verschifft.
Die zunehmende Profitabilität der Salpeterexporte führte zwischen 1879 und 1884 schließlich zum Salpeterkrieg, auch Pazifischer Krieg genannt, zwischen Chile einerseits und Peru und Bolivien andererseits um die Gebiete Región de Arica y Parinacota, Región de Tarapacá und Región de Atacama, im heutigen Norden Chiles, wo die ergiebigsten Vorkommen von Chilesalpeter zu finden waren. Mit der Erfindung des Haber-Bosch-Verfahrens und der damit verbundenen Erzeugung von synthetischem Natriumnitrat verlor die Gewinnung von Chilesalpeter aus den chilenischen Vorkommen ständig an Bedeutung.