Diabetes: Studie zum Sättigungsmechanismus liefert neue Erkenntnisse
Eptin, das Sättigungshormon oder appetitzügelnde Hormon, wird vom Fettgewebe in einer Menge ausgeschüttet, die proportional zu den Fettreserven des Körpers ist, und reguliert den Appetit, indem es das Sättigungsgefühl steuert. Es wird von Tanyzyten - Zellen, in die es durch Bindung an die LepR-Rezeptoren eindringt - zum Gehirn transportiert. Tanyzyten sind also das Tor zum Gehirn, das Leptin hilft, die Blut-Hirn-Schranke zu überwinden und die Sättigungsinformation an die Neuronen zu übermitteln.
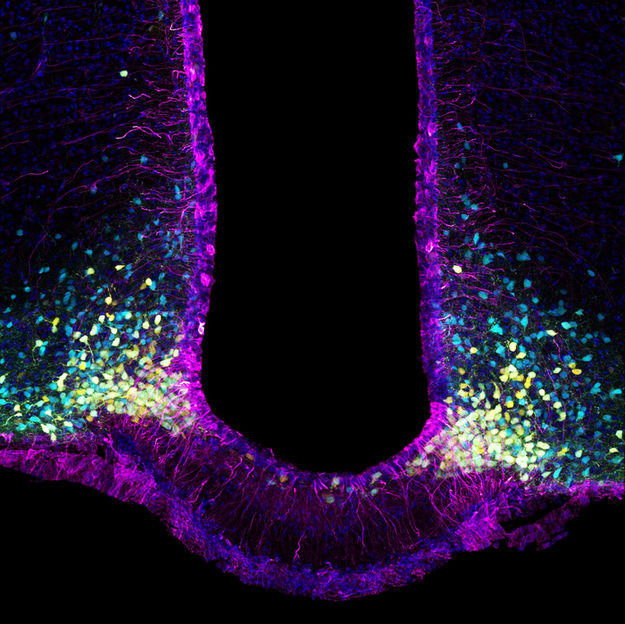
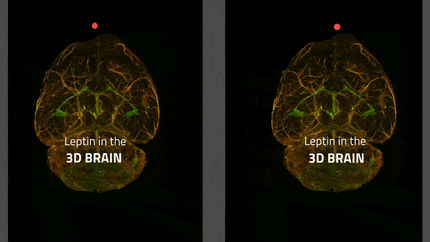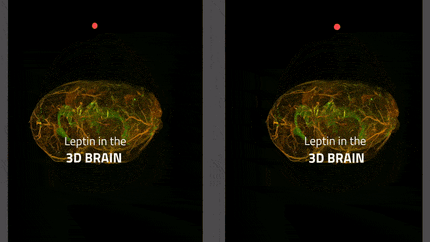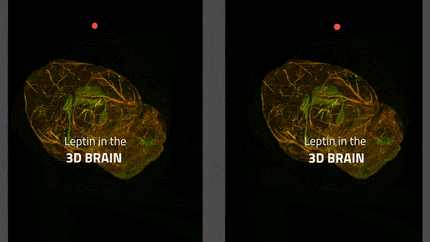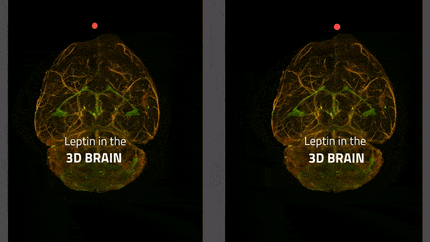
In lila die Tanyzyten, die das zelluläre Tor des Gehirns zum Hormon Leptin bilden; in gelb die appetitanregenden Neuronen und in blau die appetitunterdrückenden Neuronen. Leptin wirkt auf beide Neuronentypen, indem es die ersteren hemmt und die letzteren durch sein appetithemmendes Signal aktiviert.
Inserm/Vincent Prévot
Frühere Forschungsarbeiten haben gezeigt, dass dieser Transport bei fettleibigen oder übergewichtigen Personen gestört ist. Dies erklärt in gewisser Weise ihre gestörte Appetitregulierung, da es für die Sättigungsinformationen schwieriger ist, das Gehirn zu erreichen. In ihrer neuen Studie haben die Forscher diesen Transportmechanismus genauer unter die Lupe genommen, insbesondere die Rolle der LepR-Rezeptoren.
Die Schlüsselrolle der Sättigungshormonrezeptoren beim Glukosemanagement
In Mausmodellen entfernten die Forscher den LepR-Rezeptor, der sich auf der Oberfläche der Tanyzyten befindet. Nach drei Monaten verzeichneten die Mäuse eine deutliche Zunahme ihrer Fettmasse (die sich in diesem Zeitraum verdoppelte) sowie einen Verlust an Muskelmasse (um mehr als die Hälfte reduziert). Die Gewichtszunahme war insgesamt nur mäßig. Die Wissenschaftler maßen auch regelmäßig den Blutzuckerspiegel der Tiere nach der Injektion von Glukose.
Sie stellten fest, dass die Mäuse in den ersten vier Wochen des Versuchs mehr Insulin ausschütteten, um den Blutzuckerspiegel auf einem normalen Niveau (zwischen 0,70 und 1,10 g/L) zu halten. Drei Monate nach der Entfernung des Rezeptors schien ihre Fähigkeit, Insulin aus der Bauchspeicheldrüse abzusondern, erschöpft zu sein.
Die Entfernung der LepR-Rezeptoren und die Beeinträchtigung des Leptintransports zum Gehirn führten also dazu, dass die Mäuse zunächst einen prä-diabetischen Zustand entwickelten. Dies ist der Fall, wenn der Körper mehr Insulin als üblich ausschüttet, um den Blutzucker zu kontrollieren. Längerfristig waren die Mäuse dann nicht mehr in der Lage, Insulin auszuschütten und somit ihren Blutzuckerspiegel zu kontrollieren. Diese Daten deuten also darauf hin, dass ein gestörter Leptintransport zum Gehirn über die LepR-Rezeptoren eine Rolle bei der Entstehung von Typ-2-Diabetes spielt.
Im letzten Teil ihrer Forschung führten die Wissenschaftler Leptin wieder in das Gehirn ein und beobachteten die sofortige Wiederaufnahme seiner die Bauchspeicheldrüsenfunktion fördernden Wirkung - insbesondere die Fähigkeit der Bauchspeicheldrüse, Insulin zur Blutzuckerregulierung auszuschütten. Die Mäuse erlangten schnell wieder einen gesunden Stoffwechsel.
Diese Studie klärt also die Rolle des Gehirns bei Typ-2-Diabetes auf und trägt dazu bei, die Erforschung einer Krankheit voranzutreiben, von der man bis dahin annahm, dass sie das zentrale Nervensystem nicht betrifft.
"Wir zeigen, dass die Wahrnehmung von Leptin im Gehirn für die Steuerung der Energiehomöostase[1] und des Blutzuckerspiegels wesentlich ist. Wir zeigen auch, dass die Blockierung des Leptintransports zum Gehirn die Funktion der Neuronen, die die Insulinsekretion der Bauchspeicheldrüse steuern, beeinträchtigt", schließt Vincent Prévot, Forschungsdirektor am Inserm und letzter Autor der Studie.
[1] Stabilisierung, Regulierung bestimmter physiologischer Eigenschaften (Nahrungsaufnahme, Energieverbrauch usw.) in lebenden Organismen.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.