Die Benzoesäure wurde nach ihrem Ausgangsmaterial, dem Benzoeharz, benannt. Diese Bezeichnung wiederum ist malaysischen Ursprungs und hieß ursprünglich lubân djawi = „Weihrauch von Java“. Mit der gleichnamigen Droge wanderte der Name nach Westen, zunächst in den Mittelmeerraum. Aus dem Fortfall des Anlautes lu- wurde über banjawi, beijoim, belzui, schließlich benzoe. Der Trivialname Benzoesäure wird dabei in der IUPAC-Nomenklatur beibehalten.
Benzoesäure
Benzoesäure (IPA: [ˈbɛnt͜soeˌzɔɪ̯ʀə], anhörenⓘ/?) ist eine aromatische Carbonsäure und das einfachste Mitglied der Gruppe der aromatischen Carbonsäuren. Sie ist eine schwache Säure und ein Vorläufer für die Synthese vieler wichtiger organischer Verbindungen ist. Sie besteht aus einem Phenylrest mit einer Carboxygruppe. Die Salze und Ester der Benzoesäure werden Benzoate genannt.
Als ein Hauptbestandteil des Harzes Benzoe ist Benzoesäure in Weihrauch – vorwiegend im russisch-orthodoxen Raum – enthalten. Benzoe ist das Harz zweier Baumarten aus der Gruppe der Storaxbaumgewächse (Styracaceae), der „Siam-Benzoe“ (Styrax tonkinensis) und der „Sumatra-Benzoe“ (Styrax benzoin), die beide in Südostasien beheimatet sind. Daneben findet sich Benzoesäure auch in Früchten, zum Beispiel im Paradiesapfel Malus pumila, Preiselbeeren (bis 0,24 % Gehalt), Himbeeren, Heidelbeeren und Pflaumen (Gehalt 0,1–0,2 %) und im Wehrsekret verschiedener Schwimmkäfer der Gattung Dytiscus. Weiterhin kommt Benzoesäure auch in vielen Lebensmitteln wie Milch und Milchprodukten sowie in Honig vor.
Im Bereich von Lebensmittelzusatzstoffe agieren zahlreiche Unternehmen, die mit ihren Produkten und Dienstleistungen Lösungen für dieses Thema anbieten. Die Firmenliste bietet einen umfassenden Überblick über die Akteure, die im Bereich Lebensmittelzusatzstoffe eine Schlüsselrolle spielen. Von etablierten Branchenführern bis hin zu aufstrebenden Start-ups, jedes Unternehmen trägt auf seine Weise zur Dynamik und Entwicklung von Lebensmittelzusatzstoffe bei.
| Unternehmen | Herkunft | Typ |
|---|---|---|

|
Marly, Schweiz | Hersteller |

|
Laudenbach, Deutschland | Hersteller |

|
Hamburg, Deutschland | Hersteller |

|
Lausanne, Schweiz | Dienstleister |

|
Epalinges, Schweiz | Hersteller |

|
Burnaby, Kanada | Hersteller |

|
München, Deutschland | Hersteller |

|
Zürich, Schweiz | Dienstleister |

|
Emmerthal, Deutschland | Hersteller |
Benzoesäure bildet farblose, glänzende Blättchen oder nadelförmige Kristalle, die in kaltem Wasser nur wenig, in warmem Wasser dagegen besser löslich sind. Bei über 370 °C zersetzt sich Benzoesäure langsam in Benzol und Kohlenstoffdioxid (CO2). Benzoesäure hat einen intensiven Geruch und ist brennbar. Der Flammpunkt liegt bei 140 °C, die Zündtemperatur bei 570 °C.
Benzoesäure kann über eine Grignard-Reaktion ausgehend von Brombenzol dargestellt werden. Das Brombenzol reagiert mit Magnesium zu Phenylmagnesiumbromid, welches mit Kohlenstoffdioxid zu C6H5COOMgBr und schließlich durch Zugabe einer Salzsäurelösung zu Benzoesäure reagiert.
Ferner kann Benzoesäure durch Carboxylierung von Benzol mittels Phosgen und Aluminiumtrichlorid (AlCl3) als Katalysator dargestellt werden. Diese Reaktion besteht aus einer Friedel-Crafts-Acylierung und anschließender Hydrolyse des Zwischenprodukts Benzoylchlorid:
Technisch erfolgt eine Oxidation von Toluol mit Braunstein und Schwefelsäure in Gegenwart von Mangannaphthenat, oder durch die Reaktion mit Kaliumpermanganat. Industriell wird heute Toluol mit Sauerstoff in der Gasphase in Gegenwart von Katalysatoren wie Vanadiumpentoxid oxidiert.
Im Labor kann Benzoesäure ausgehend von Natriumbenzoat synthetisiert werden. In Gegenwart von Salzsäure oder Essigsäure reagiert Natriumbenzoat zur Benzoesäure und Natriumchlorid bzw. Natriumacetat:
In der Welt des Themas Lebensmittelzusatzstoffe gibt es ständig Neues zu entdecken. Aktuelle Entwicklungen und spannende Meldungen bieten tiefe Einblicke und erweitern das Verständnis für dieses dynamische Feld. Von bahnbrechenden Entdeckungen bis hin zu wichtigen Ereignissen – die Entwicklungen für das Thema Lebensmittelzusatzstoffe sind ein Spiegelbild des stetigen Wandels und der Innovation in diesem Bereich.
Benzoesäure wird bei der Herstellung von Benzoesäureestern gebraucht, die in der Parfümindustrie als Duftstoffe (wie Benzoesäureethylester) oder als Biozide (beispielsweise Benzoesäurebenzylester) Anwendung finden. Auch bestimmte Lokalanästhetika sind Ester der Benzoesäure. Außerdem wird Benzoesäure für Weichmacher, bei der Darstellung von Benzoylverbindungen, wie Benzoylchlorid und Dibenzoylperoxid, verwendet.
In der Lebensmittelindustrie wird Benzoesäure (E 210) als Konservierungsmittel in Fischprodukten, Sauerkonserven und Obstprodukten eingesetzt wo sie das Wachstum von Schimmelpilzen hemmt. Hefen, die als Kontaminanten z. B. in Erfrischungsgetränken auftreten können, werden ebenfalls unterdrückt. Wegen besserer Löslichkeit ist eher die Verwendung der Salze üblich: Natriumbenzoat (E 211), Kaliumbenzoat (E 212), Calciumbenzoat (E 213). Außerdem ist Benzoesäure in der europäischen Union als Futtermittelzusatzstoff für Mastschweine zugelassen.
Weiterhin wird Benzoesäure häufig als Konservierungsstoff in Tabakprodukten verwendet. Die deutsche und die Schweizer Tabakverordnung gestattet den Einsatz von Benzoesäure und Natriumbenzoat.
Benzoesäure wird zur Behandlung von Hautpilzen eingesetzt und ist gemäß deutscher Kosmetik-Verordnung zur Konservierung von Kosmetika zugelassen. Die bakteriostatische und fungistatische Wirkung beruht auf dem Hemmeffekt gegenüber Enzymen, die reaktive Sauerstoffspezies abbauen (Katalase und Peroxidase), wodurch eine Wasserstoffperoxid-Ansammlung in den Zellen der Mikroorganismen erzeugt wird. Diese führt letztlich zu deren Absterben.
In der Umweltbeobachtung werden Bodenfallen mit gesättigter Benzoesäurelösung gefüllt, um erfasste Lebewesen wie Insekten oder Schnecken zu töten und bis zur nächsten Leerung zu fixieren.
Benzoesäure ist eine Urtitersubstanz nach Arzneibuch.
Benzoesäure ist ein lungenschädigender Stoff und kann asthmaartige Symptome hervorrufen. Als Reinstoff wirkt sie ätzend und kann schwere Augenschäden verursachen.
Im Zusammenhang mit Konzentrationsproblemen und Hyperaktivität bei Kindern konnten keine kausalen Zusammenhänge mit der Aufnahme des Zusatzstoffes gezeigt werden. Die beobachteten Effekte seien wenn dann nur sehr gering und es konnte kein biologischer Mechanismus abgeleitet werden, der etwaige Effekte erklären könnte. Die EFSA sah von einer Neubewertung ab. Das BfR wies auf eine mögliche Bildung von geringen Mengen giftigen Benzols aus Benzoesäure in Verbindung mit Ascorbinsäure (Vitamin C) in Erfrischungs- und Fruchtsäften hin.
Im Bereich von Lebensmittelzusatzstoffe bieten White Papers und Fachartikel weitergehende Einblicke und fundiertes Wissen. Diese Sammlung von Fachwissen bietet Ressourcen für alle, die sich eingehend mit den Facetten und Nuancen des Themas Lebensmittelzusatzstoffe beschäftigen möchten. Diese Auswahl an Veröffentlichungen deckt ein breites Spektrum ab – von theoretischen Überlegungen bis hin zu praktischen Anwendungen und Fallstudien - und umfasst Arbeiten von Experten, die Licht auf die komplexen Aspekte von Lebensmittelzusatzstoffe werfen.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
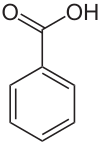 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Benzoesäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C7H6O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff mit charakteristischem Geruch | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 122,12 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,27 g·cm−3 (20 °C) | |||||||||||||||||||||
| Schmelzpunkt |
122 °C | |||||||||||||||||||||
| Siedepunkt |
250 °C | |||||||||||||||||||||
| Dampfdruck |
0,001 hPa (20 °C) | |||||||||||||||||||||
| pKS-Wert |
4,2 | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,504 (132 °C) | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten |
| |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||

Holen Sie sich die Lebensmittel- und Getränke-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für die Lebensmittel- und Getränkeindustrie bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.







