Vanille als Aroma wurde von präkolumbischen Völkern Mittelamerikas geschätzt. Die Azteken nutzten sie für die Bereitung des Getränks cacahuatl, als Hernán Cortés Mexiko eroberte. Damit wurden um das Jahr 1520 Europäern sowohl der Kakao als auch die Vanille bekannt.
Vanillin wurde erstmals im Jahre 1858 als relativ reine Substanz von Nicolas-Théodore Gobley isoliert; dies geschah durch vollständiges Eindampfen eines Vanilleextrakts und anschließendes Umkristallisieren aus heißem Wasser. Im Jahr 1874 gelang erstmals dem Chemiker Wilhelm Haarmann zusammen mit Ferdinand Tiemann in Holzminden die Herstellung von Vanillin aus Coniferin, das im Rindensaft von Nadelhölzern (Coniferen) vorkommt.
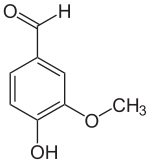
1876 synthetisierte Karl Reimer erstmals aus Guajacol (1) das Vanillin (2). In der später als Reimer-Tiemann-Reaktion benannten Synthese wird Guajacol im Alkalischen mit Chloroform umgesetzt. Dabei reagiert zuerst Chloroform mit der Base zu Dichlorcarben. Dieses lagert sich am Phenolat-Anion des Guajacols an.