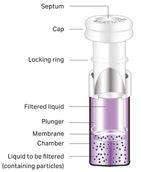
| IZ | Typ | Beispiele |
|---|---|---|
| <10 | nicht trocknend | gesättigte Öle, Bienenwachs, Kokosfett, Kokosöl, Neutralöl |
| 10–20 | Palmkernöl, Babassuöl, Murumurufett | |
| 20–50 | Rindertalg, Butter, Kakaobutter, Palmöl | |
| 50–100 | Olivenöl, Avocadoöl, Jojobaöl, Mandelöl, Palmöl, Sheabutter, Rizinusöl | |
| 100–130 | halb trocknend | Maiskeimöl, Sonnenblumenöl, Rapsöl, Sesamöl, Weizenkeimöl |
| 130–170 | Sojaöl, Erdnussöl, Distelöl, Hanföl, Mohnöl, Traubenkernöl, Walnussöl, Wildrosenöl, Johannisbeerkernöl, Kukuinussöl | |
| >170 | trocknend | Leinöl (169–192), Perillaöl, Isanoöl, Tungöl, Stillingiaöl, Lallemantiaöl |
Iodzahl
Die Iodzahl (IZ) oder Jodzahl ist eine Fettkennzahl zur Charakterisierung von Fetten und Ölen. Sie ist ein Maß für den Gehalt eines Fettes an ungesättigten Verbindungen – genauer: ungesättigte Fettsäurereste in den Glyceriden. Es ist die Menge in Gramm Halogen, berechnet als Iod, die formal an 100 g Fett addiert werden kann. Je mehr olefinische Doppelbindungen (C=C-Bindungen) es in einem Fett gibt, desto mehr Iod kann formal addiert werden und desto höher ist somit die Iodzahl. Daneben werden auch weitere olefinische Begleitstoffe wie Sterine mit erfasst.
Die Methode kann zur Identifizierung und Qualitätskontrolle eingesetzt werden. Man klassifiziert Lipide anhand ihres Sättigungsgrades, da dieser ausschlaggebend für das Altern („Trocknen“) bei der Lagerung ist; Fette und Öle mit höherer Iodzahl altern schneller.
Beim Erhitzen von ungesättigten Fetten (z. B. beim Frittieren) nimmt die Iodzahl ab, und deren Viskosität steigt durch Polymerisation an.
Fette und fette Öle bestehen immer aus einem Gemisch von Fettsäure-Glyceriden. Ihre Eigenschaften bestimmen sich daher anteilmäßig aus der Summe der in ihnen vorkommenden Fettsäurekomponenten.
Gesättigte Fettsäuren enthalten keine Kohlenstoff-Kohlenstoff-Doppelbindungen und haben damit eine niedrige Iodzahl. Diese Fette eignen sich gut zur Herstellung von Seife.
Je höher der Anteil ungesättigter Fettsäurereste unter den Fettsäureresten der Triglyceride ist, desto höher die Iodzahl und desto eher neigen Öle zur Vernetzung (Polymerisation). Leicht polymerisierende Öle wie Leinöl haben eine Iodzahl von mehr als 140 und werden trocknende bzw. härtende Öle genannt. Halbtrocknende Öle haben eine Iodzahl zwischen 100 und 140; bei nichttrocknenden Ölen liegt sie unter 100.
Im Bereich von Lebensmittelanalytik agieren zahlreiche Unternehmen, die mit ihren Produkten und Dienstleistungen Lösungen für dieses Thema anbieten. Die Firmenliste bietet einen umfassenden Überblick über die Akteure, die im Bereich Lebensmittelanalytik eine Schlüsselrolle spielen. Von etablierten Branchenführern bis hin zu aufstrebenden Start-ups, jedes Unternehmen trägt auf seine Weise zur Dynamik und Entwicklung von Lebensmittelanalytik bei.
| Unternehmen | Herkunft | Typ |
|---|---|---|

|
Hamburg, Deutschland | Hersteller |

|
Ettlingen, Deutschland | Hersteller |

|
Berlin, Deutschland | Labor |

|
Hägersten, Schweden | Hersteller |

|
Schlieren, Schweiz | Hersteller |

|
Lausanne, Schweiz | Hersteller |

|
Dresden, Deutschland | Dienstleister |

|
Hamburg, Deutschland | Dienstleister |

|
Boston, USA | Dienstleister |

|
Stuttgart, Deutschland | Dienstleister |
Hübl
Eingeführt wurde die Iodzahl durch Arthur von Hübl, der Fette in Gegenwart von Quecksilberchlorid mit Iod titrierte, wobei aber das eigentliche Reagens (wohl Iodchlorid) in situ aus Quecksilberchlorid und Iod entsteht. Reines Iod lagert sich nämlich nicht an Alkene an, weshalb die heute noch gültige Definition der Iodzahl lediglich eine formale ist.
Wijs
Die Iodzahlbestimmung nach Wijs erfolgt nach DIN 53241-1:1995-05 (zurückgezogen) bzw. EN 14111:2003. Sie basiert auf der Addition von Iodmonochlorid an die olefinische Doppelbindung.
Die Probe wird in Chloroform (oder einem anderen organischen Lösungsmittel, z. B. Cyclohexan) gelöst und anschließend im Überschuss mit Iodlösung nach Wijs versetzt. Die Iodlösung nach Wijs enthält ein organisches Lösungsmittel, reine Essigsäure (Eisessig), elementares Iod und Iodtrichlorid. Iod und Iodtrichlorid setzen sich in der Lösung vollständig zu Iodmonochlorid um.
Wichtig hierbei ist, dass die Iodlösung wasserfrei ist, da Iodmonochlorid in Wasser in Chlorwasserstoff, Iod und Iodsäure zerfällt. Um die Bildung von Iodradikalen und somit eine Verfälschung des Ergebnisses auszuschließen wird die Probe nach Zugabe der Iodlösung im Dunkeln verwahrt. Es kommt zu einer elektrophilen Additionsreaktion von Iodmonochlorid an die Doppelbindung.
Anschließend wird das übrig gebliebene Iodmonochlorid mit Kaliumiodid umgesetzt.
Das entstandene Iod wird mit Natriumthiosulfat und Stärke als Indikator titriert.
Kaufmann
(Bromierung der Doppelbindungen unter Lichtausschluss, Reduktion des überschüssigen Broms mit Iodid, Rücktitration des Iods mit Thiosulfat)
Bei der Bestimmung der Iodzahl nach H. P. Kaufmann wird das Fett mit einem Überschuss an Brom versetzt. Hierbei wird Brom an die Doppelbindungen in den ungesättigten Fetten addiert. Diese Reaktion muss im Dunklen durchgeführt werden, da so die Bildung von Bromradikalen durch Licht unterbunden wird. Dies würde zu unerwünschten Nebenreaktionen führen, und so zu einem Ergebnis verfälschenden Mehrverbrauch an Brom.
Anschließend wird das nicht verbrauchte Brom mit Iodid zum Bromid reduziert.
Nun wird die Menge des entstandenen Iods durch Titration mit Natriumthiosulfat-Lösung bestimmt.
Die Welt von Lebensmittelanalytik ist reich an Produkten, die in diesem Themenfeld zum Einsatz kommen. Diese Produktliste präsentiert eine Auswahl von Geräten und Materialien, die für das Thema Lebensmittelanalytik relevant sind. Diese Produkte reichen von technologischen Durchbrüchen bis hin zu erprobten Systemen, die routinemässig im Bereich Lebensmittelanalytik zum Einsatz kommen.
In der Welt des Themas Lebensmittelanalytik gibt es ständig Neues zu entdecken. Aktuelle Entwicklungen und spannende Meldungen bieten tiefe Einblicke und erweitern das Verständnis für dieses dynamische Feld. Von bahnbrechenden Entdeckungen bis hin zu wichtigen Ereignissen – die Entwicklungen für das Thema Lebensmittelanalytik sind ein Spiegelbild des stetigen Wandels und der Innovation in diesem Bereich.
Im Bereich von Lebensmittelanalytik bieten White Papers und Fachartikel weitergehende Einblicke und fundiertes Wissen. Diese Sammlung von Fachwissen bietet Ressourcen für alle, die sich eingehend mit den Facetten und Nuancen des Themas Lebensmittelanalytik beschäftigen möchten. Diese Auswahl an Veröffentlichungen deckt ein breites Spektrum ab – von theoretischen Überlegungen bis hin zu praktischen Anwendungen und Fallstudien - und umfasst Arbeiten von Experten, die Licht auf die komplexen Aspekte von Lebensmittelanalytik werfen.

Holen Sie sich die Lebensmittel- und Getränke-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für die Lebensmittel- und Getränkeindustrie bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.