Explorer comment le poivre pousse
L'Institut de biochimie végétale de Leibniz (IPB) élucide la biosynthèse du piquant
Comment les plantes produisent-elles des substances piquantes ? L'Institut Leibniz de biochimie végétale (IPB) s'intéresse de près à cette question. Récemment, les scientifiques du Dr Thomas Vogt ont trouvé l'enzyme décisive qui confère aux fruits du poivrier (Piper nigrum en latin) leur piquant caractéristique. L'enzyme découverte, la pipérine synthase, catalyse l'étape finale de la biosynthèse de la pipérine au goût piquant. Les biochimistes ont maintenant ajouté une deuxième substance piquante et se sont également penchés sur la biosynthèse de la capsaïcine à partir du piment (Capsicum spec.). Pour la première fois, son groupe de travail décrit l'activité enzymatique de la capsaïcine synthase, longtemps recherchée. Cette enzyme catalyse la dernière étape de réaction de la production végétale de capsaïcine.
La pipérine et la capsaïcine se lient sur la langue et les muqueuses à l'endroit précis du récepteur qui réagit également à la chaleur, aux acides ou aux blessures. Ce récepteur déclenche dans certaines cellules nerveuses un stimulus que l'homme perçoit comme du piquant. La capsaïcine et la pipérine ont en outre un effet antimicrobien et favorisent la digestion et la circulation sanguine. Ils sont donc intéressants non seulement en tant que piquants, mais aussi en tant que substances actives pour des applications médicales. "On trouve dans la littérature de ces dernières années des centaines d'études sur l'effet biologique des extraits de poivre et de piment, mais très peu sur la biosynthèse des substances piquantes", explique Thomas Vogt, qui dirige à l'IPB le groupe de travail sur le métabolisme du phénylpropane.
Cela peut s'expliquer par le fait que l'élucidation des voies de biosynthèse des plantes nécessite différentes expertises qui ne sont disponibles dans cette combinaison que dans quelques instituts de recherche. Dans l'idéal, les chimistes, les biochimistes et les bioinformaticiens travaillent de concert pour trouver, parmi les centaines d'enzymes d'une plante, la poignée de candidats qui participent à la production de la substance recherchée. Cette recherche d'enzymes individuelles est surtout difficile pour les espèces végétales dont la plupart des gènes et des enzymes sont encore inconnus. "Car ici", dit Thomas Vogt, "on ne peut consulter les bases de données que de manière limitée".
Pour le poivre aussi, les données étaient minces et d'autres obstacles se sont dressés. Ainsi, les scientifiques de Halle ont d'abord dû cultiver des plants de poivre et surtout s'assurer qu'ils portent des fruits. "Cela ne va pas de soi pour le poivre qui pousse en serre", explique le biochimiste, "mais les jardiniers de l'institut y sont parvenus". Avec une culture réussie des plantes, l'équipe de chercheurs a pu récolter des baies de poivre à différents stades de maturité sur une période de trois mois et observer ici avec précision l'augmentation constante de leur teneur en pipérine. Selon la thèse des scientifiques, les enzymes qui forment la pipérine devraient donc se trouver dans les baies en cours de maturation. En revanche, les feuilles de la plante ne devraient pas contenir les enzymes de biosynthèse de la pipérine, car elles ne produisent pas de pipérine et n'ont donc pas de goût piquant.
Les scientifiques ont exploité ces différences de teneur en pipérine, c'est-à-dire la présence ou l'absence des enzymes de biosynthèse de la pipérine. Partant du principe qu'une enzyme n'est présente dans certains tissus que si son gène est activé et lu, ils ont comparé l'activité des gènes dans les feuilles et les fruits à différents stades de maturité. Ils ont ainsi pu identifier les gènes qui sont particulièrement actifs dans les fruits immatures. Parmi eux, le gène de la pipérine synthase. Ce gène a ensuite été introduit dans des micro-organismes et a servi de modèle aux bactéries pour la production de l'enzyme pipérine synthase. Les experts en poivre de Halle ont ensuite pu prouver sans l'ombre d'un doute que l'enzyme isolée catalyse la fusion des deux substances de départ, le pipéroyl-CoA et la pipéridine, en pipérine. La preuve qu'il s'agit bien de la pipérine synthase recherchée était ainsi apportée.
Lors de la découverte de la capsaïcine synthase, les problèmes étaient différents. Le gène codant avait déjà été identifié, mais la science n'avait jamais réussi à en faire une protéine enzymatiquement active dans des bactéries. Il restait donc à prouver que le gène étudié était bien la capsaïcine synthase. Mais grâce à leurs connaissances sur l'enzyme de poivre relativement similaire, les chercheurs en botanique de Halle ont pu isoler la capsaïcine synthase et prouver, lors du test final d'activité, qu'elle catalyse effectivement la réaction postulée depuis longtemps des deux substances de départ, le 8-méthyl-6-nonenoyl-CoA et la vanilloylamine, pour former la capsaïcine. Ces preuves finales de l'activité de la pipérine et de la capsaïcine synthase ont été obtenues entre autres parce que les chimistes de synthèse de l'institut ont pu produire eux-mêmes toutes les substances de départ, qui ne sont pas encore disponibles à la vente, et les mettre à disposition pour les tests enzymatiques.
Les principales étapes de réaction de la biosynthèse de la pipérine et de la biosynthèse de la capsaïcine sont ainsi élucidées. Un jour, les deux voies de biosynthèse seront entièrement comprises. Mais quel est le bénéfice de cette connaissance ? En connaissant toutes les enzymes impliquées dans une biosynthèse, on peut introduire les gènes correspondants dans des micro-organismes et leur faire produire la substance active souhaitée. "Dans le cas du poivre, ce ne serait toutefois pas rentable", explique Thomas Vogt, "car la pipérine est présente dans les baies de poivre à une concentration si élevée qu'elle pourrait être isolée très facilement, par exemple à des fins médicales".
Pour les scientifiques de l'IPB, l'élucidation des voies de biosynthèse vaut néanmoins la peine, car les enzymes nouvellement découvertes catalysent des réactions intéressantes qui conduisent à des produits de réaction aux structures compliquées. Ces enzymes peuvent être modifiées par les biochimistes, ce qui permet de créer des enzymes entièrement nouvelles aux propriétés souhaitées. Les enzymes optimisées sont ensuite utilisées pour concevoir en éprouvette des synthèses de nouvelles substances potentiellement efficaces. Ce type de synthèse biocatalytique - c'est-à-dire l'imitation et l'optimisation de la biosynthèse végétale originale en éprouvette - a un énorme potentiel d'avenir en tant que champ de recherche relativement jeune. En tant qu'alternative aux synthèses pétrochimiques, la biocatalyse peut produire des substances souhaitées sans l'utilisation de catalyseurs et de solvants toxiques ou la création de sous-produits nocifs.
Contexte : biosynthèses et enzymes
Les enzymes sont des protéines présentes dans chaque être vivant et dans chaque cellule. Chaque réaction dans le corps au cours de laquelle une substance est transformée en une autre substance (métabolisme) est catalysée par une enzyme. Dans chaque organisme, il existe des milliers de réactions métaboliques et donc autant d'enzymes différentes. Plusieurs réactions individuelles successives forment des voies métaboliques ou biosynthétiques distinctes, qui conduisent à de nombreux produits finaux différents. Les plantes sont supérieures aux animaux dans leur capacité à produire un large éventail de substances complexes. C'est pourquoi elles disposent de beaucoup plus d'enzymes que les organismes animaux. L'homme utilise les enzymes depuis des millénaires, par exemple pour la production de pain, de choucroute, d'alcool et de fromage.
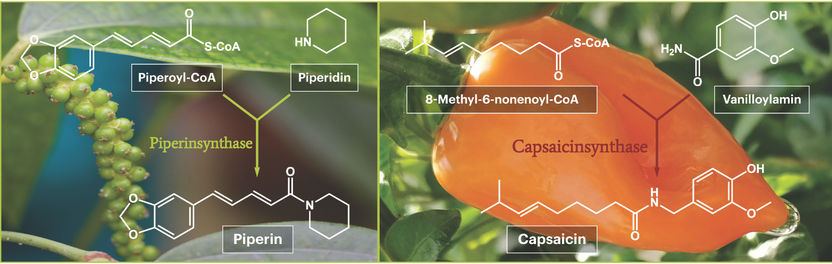
L'étape finale de la biosynthèse de la pipérine au goût piquant issue du poivrier (à gauche) et de la production de capsaïcine dans les fruits piquants du chili (à droite).
Thomas Vogt, IPB
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Allemand peut être trouvé ici.





















































